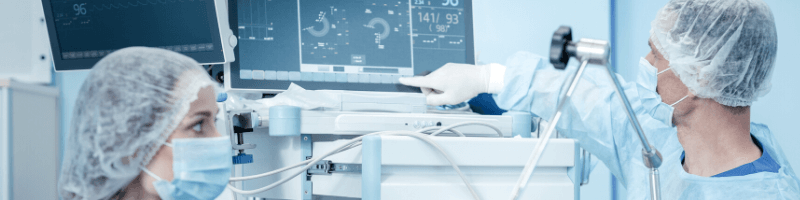
Information importante pour toutes celles et ceux qui souhaitent se former et mettre à jour leurs connaissances : le nouveau règlement européen sur les dispositifs médicaux UE 2017/745 entrera finalement en application le 26 mai 2021. Soit un an après la date prévue. La crise liée à la pandémie de covid-19 est passée par là, mais ce sursis offre un délai supplémentaire appréciable pour l’ensemble des acteurs du secteur. Et si vous en profitiez pour parfaire vos connaissances avec une petite formation ? AFNOR Compétences vous en propose plusieurs, tant sur le volet management de système qualité que sur le volet réglementaire.
Faire démontrer, par les fabricants, qu’ils maîtrisent les risques tout au long du cycle de vie de leurs produits, tel est l’esprit de ce nouveau règlement. En cela, il prend la succession de la directive européenne 93/42. Mais à la lumière des divers scandales qui ont secoué le secteur, par exemple celui des prothèses mammaires au début des années 2010, le ton s’est durci.
"Les acteurs des dispositifs médicaux doivent démontrer encore davantage qu’ils respectent les exigences de performances cliniques et de sécurité. "
Et cela, pour le bénéfice des patients, et sur toute la chaîne de valeur : fabricants, experts, auditeurs mais également mandataires, importateurs et distributeurs au sein de l’UE.
ISO 13485 : une formation pour devenir auditeur
En l’espèce, les bonnes pratiques de management de la qualité sont décrites dans une norme volontaire de 2016, la norme ISO 13485. Fins connaisseurs de ce texte qui fait référence dans le monde entier, les consultants-formateurs d’AFNOR Compétences peuvent vous y former. Y compris si vous voulez devenir auditeur spécialisé, et vous rendre dans les entreprises et laboratoires désireux d’obtenir un signe de reconnaissance prouvant qu’ils l’appliquent à la lettre. Ce signe de reconnaissance, c’est la certification ISO 13485. En la présentant, le certifié rassure ses clients sur son aptitude à maîtriser les risques au sens du règlement européen.
AFNOR Compétences vous forme à l’audit, mais également aux subtilités du marquage CE, obligatoire qui met sur le marché des dispositifs médicaux sur le territoire de l’Union européenne. Ce signe, reconnaissable au petit logo « CE » aux lettres arrondies, donne aux produits concernés le droit de circuler librement dans toute l’UE, en sous-entendant que ces produits sont conformes aux textes réglementaires européens (directives ou règlements) qui les concernent.
De même, vous pouvez vous former aux dispositions de l’article 15 du nouveau règlement UE 2017/745, qui exige du fabricant qu’’il emploie une « personne chargée de veiller au respect de la réglementation ». « Celle-ci devra détenir un diplôme ou un certificat pour démontrer l’expertise requise. Si la compétence ne peut être interne à l’entreprise, il conviendra alors d’établir un contrat avec un organisme externe », précise Anthony Delamotte, directeur de l’entité AFNOR Medical au sein du groupe AFNOR. Sur ce point aussi, AFNOR Compétences accompagne tous les publics concernés : auditeur interne ou externe, responsable qualité, responsable des affaires réglementaires, etc. Avec des experts de haut niveau : les formateurs AFNOR Compétences disposent a minima d’un socle de quatre ans dans l’industrie médicale.
Découvrez notre offre sur les métiers des dipositifs médicaux :
https://competences.afnor.org/gammes/metiers-des-dispositifs-medicaux
Découvrez notre offre sur la qualité et les affaires reglementaires :
https://competences.afnor.org/gammes/qualite-et-affaires-reglementaires
Anthony Delamotte,
Directeur de l’entité AFNOR Medical